~本疾患に対する新たな治療法や創薬へ期待~
【本研究成果のポイント】
- 日本人家系において脊髄小脳変性症(spinocerebellar degeneration; SCD)(※1)の原因遺伝子として、CACNA1G遺伝子(※2)を同定しました。
- CACNA1G遺伝子変異を有する患者さんから得られた皮膚線維芽細胞を用いてiPS細胞を樹立し、小脳プルキンエ細胞への分化に世界で初めて成功しました。
- 本疾患に対する新しいアプローチに基づく治療法や創薬に結びつくことが期待されます。
【概要】
広島大学原爆放射線医科学研究所 森野豊之准教授、松田由喜子研究員、川上秀史教授らの研究グループは、本学大学院医歯薬保健学研究院 橋本浩一教授、理化学研究所らとともに、日本人家系において脊髄小脳変性症(spinocerebellar degeneration; SCD)の原因遺伝子を同定し、カルシウムチャネルをエンコードするCACNA1G遺伝子の変異により常染色体優性遺伝(※3)性脊髄小脳変性症が発症することを突き止めました。
また、CACNA1G遺伝子変異を有する患者さんから得られた皮膚線維芽細胞を用いてiPS細胞を樹立し、小脳プルキンエ細胞への分化にも世界で初めて成功しました。
今回の結果は、本疾患に対する新しいアプローチに基づく治療法や創薬に結びつくことが期待されます。
本研究成果は、平成27年12月29日21時(日本時間)、英国国際学術誌“Molecular Brain”に掲載されました。
<発表論文>
著者
Hiroyuki Morino*, Yukiko Matsuda, Keiko Muguruma, Ryosuke Miyamoto, Ryosuke Ohsawa, Toshiyuki Ohtake, Reiko Otobe, Masahiko Watanabe, Hirofumi Maruyama, Kouichi Hashimoto, Hideshi Kawakami*
* Corresponding author(責任著者)
論文題目
A mutation in the low voltage-gated calcium channel CACNA1G alters the physiological properties of the channel, causing spinocerebellar ataxia.
掲載雑誌
Molecular Brain 2015 8:89
DOI
10.1186/s13041-015-0180-4
【背景】
脊髄小脳変性症(spinocerebellar degeneration; SCD)は根本的治療法の確立されていない難病で、遺伝的に多様性があることが知られています。これまでに多くの病型が報告され、常染色体優性遺伝性のものとして36病型が報告されており、そのうち31病型で原因遺伝子が同定されています。多くの神経変性疾患では、遺伝性の病型から得られた知見が病態の解明や治療法の開発に貢献しています。SCDでも遺伝子の繰り返し配列が異常伸長することによって発症する病型が最初に報告され、一部の発症メカニズムが明らかにされました。
しかし、2,000人以上のSCD症例の遺伝学的検討[1]から、優性遺伝が推測される症例のうち約30%で原因遺伝子が不明で、依然として未解明な部分も多く、さらに詳細な病態の解明が求められています。
【研究成果の内容】
本研究では、東京都保健医療公社荏原病院神経内科 大竹敏之医長と共同で収集した発症者10人を含む優性遺伝性SCDの大家系を遺伝学的に解析しました(図1)。まず、高密度一塩基多型(single nucleotide polymorphism; SNP)の結果から連鎖解析を行い、第17番染色体と第21番染色体に高確率で原因遺伝子が存在することが推測されました。さらに、遺伝子のうち蛋白質をコードしている領域のみを選択的に増幅し、次世代シーケンサを用いて塩基配列を決定するエクソームシーケンスという手法を用いて、原因となる変異を同定しました。原因変異が存在する遺伝子はCACNA1Gというカルシウムチャネルの1つをエンコードしているものでした。さらに、同一の変異は優性遺伝性SCDの別の1家系でも認められました。平成27年11月にフランス人のSCD家系で同じ変異が報告されました[2]。本研究は日本人家系を対象とし、独立した研究として原因遺伝子を同定しました。
CACNA1Gがエンコードしているカルシウムチャネルは、低電位活動型電位依存性カルシウムチャネル(T-type voltage-dependent calcium channel; T-type VDCC)の1つであるCaV3.1で、6回の膜貫通部位を4回繰り返す構造をしており、それぞれの繰り返し配列の中で4回目の膜貫通部位に電位センサーとしての役割があります。今回同定された変異は、この電位センサーに存在する重要なアミノ酸を変化させることから、生理学的な特性を変化させることが推測されました(図2)。
実際に、変異に伴うチャネル機能の変化をとらえるために、本学の橋本浩一教授とともに、培養細胞に野生型と変異型のCaV3.1を発現させ、パッチクランプ法にて解析しました。その結果、変異型のCaV3.1ではプレパルスによる電流変化が陽性電位方向にシフトしていました(図3)。
また、近年マウスおよびヒトのES細胞から小脳プルキンエ細胞への分化に成功した[3]理化学研究所多細胞システム形成研究センター六車恵子専門職研究員とともに、CACNA1Gの遺伝子異常を有する患者さんから提供していただいた皮膚から得られた皮膚線維芽細胞を用いてiPS細胞を樹立し、前述の分化方法を応用して小脳プルキンエ細胞へ分化させることにも成功しました(図4)。患者由来のiPS細胞から小脳プルキンエ細胞への分化は世界で初めてです。正常対照のiPS細胞から誘導した小脳プルキンエ細胞と比べて、免疫組織学的にも形態学的にも差は認められず、今後この疾患モデル細胞を用いて創薬への応用も期待されます。
【今後の展開】
これまでにも同様のイオンチャネル遺伝子としてCACNA1A、KCNC3、KCND3がSCDの原因遺伝子として報告され、類縁疾患である周期性失調症の原因遺伝子としてKCNA1、CACNA1A、CACNB4が知られています。臨床的に小脳失調症を呈する原因として、イオンチャネルの異常が非常に重要であると考えられ、今回の発見により新しいアプローチに基づく治療法や創薬に結びつくことが期待されます。
【その他】
本研究の一部は、日本学術振興会科学研究費補助金基盤研究(A)(川上秀史; 26242085)、新学術領域研究(川上秀史; 23111008)、挑戦的萌芽研究(森野豊之; 15K15083)、iPS細胞を活用した研究については、国立研究開発法人科学技術振興機構(JST)および国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム「疾患特異的iPS細胞を活用した難病研究」事業「高品質な分化細胞・組織を用いた神経系および視覚系難病のin vitroモデル化と治療法の開発」(六車恵子)として行ったものです。
【参考資料】
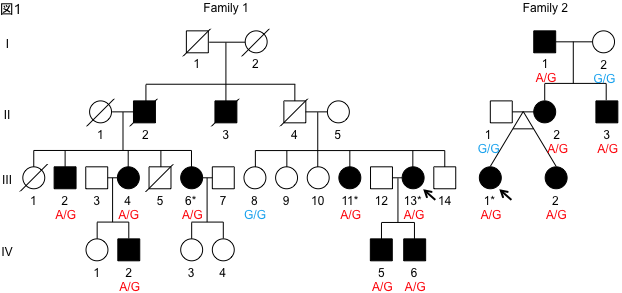
図1:遺伝性SCDの家系図
家系1は発端者(矢印)を含む10人の発症者を3世代にわたって認める。家系2では発端者(矢印)を含む5人の発症者を3世代にわたって認める。発症者のみ原因変異の遺伝型がヘテロ接合性変異を示すA/Gになっている。
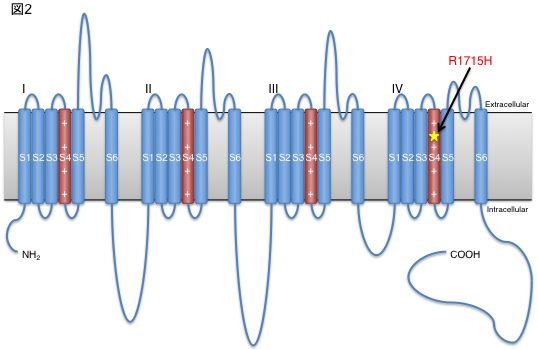
図2:CaV3.1の構造と変異の部位
同定した変異はカルシウムチャネルの電位センサーとして重要な部分に存在していた。
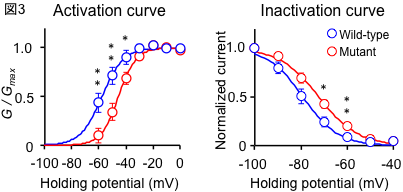
図3:変異による電気生理学的特性変化
変異によってプレパルスによる電流変化が陽性電位方向にシフトする。
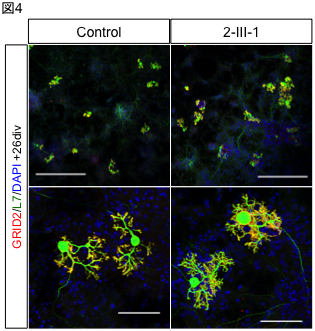
図4:患者由来iPS細胞から分化誘導した小脳プルキンエ細胞
正常対照(左)と患者由来(右)iPS細胞から誘導したプルキンエ細胞。特徴的な樹状突起が認められる。
【参考文献】
[1] Sugihara K, Maruyama H, Morino H, et al. The clinical characteristics of spinocerebellar ataxia 36: a study of 2121 Japanese ataxia patients. Mov Disord. 2012;27:1158–63.
[2] Coutelier M, Blesneac I, Monteil A, et al. A Recurrent Mutation in CACNA1G Alters Cav3.1 T-Type Calcium-Channel Conduction and Causes Autosomal-Dominant Cerebellar Ataxia. Am J Hum Genet 2015;97:1–12.
[3] Muguruma K, Nishiyama A, Kawakami H, et al. Self-Organization of Polarized Cerebellar Tissue in 3D Culture of Human Pluripotent Stem Cells. Cell Rep. 2015;10:537–50.
<用語説明>
(※1)脊髄小脳変性症(spinocerebellar degeneration; SCD)
SCDはふらつきやしゃべりにくさ、手のふるえなどを主な症状とする神経疾患で、根本的な治療法のない難病です。約1/3に遺伝歴を認め、遺伝性のものは常染色体優性遺伝および劣性遺伝、X連鎖性のものが知られている。
(※2)CACNA1G遺伝子
細胞の脱分極によって開口する電位依存性カルシウムチャネルのうち低電位活動型(T型)のものの1つであるCaV3.1をエンコードしている遺伝子。主に脳や心臓で発現し、ペースメーキングなど反復性の活動に関係している。
(※3)常染色体優性遺伝
1対の相同遺伝子のうち少なくとも片方に変異がある場合に発症する遺伝形式。